A형 혈우병 치료제 급여기준 확대…형평성 논란 그림자
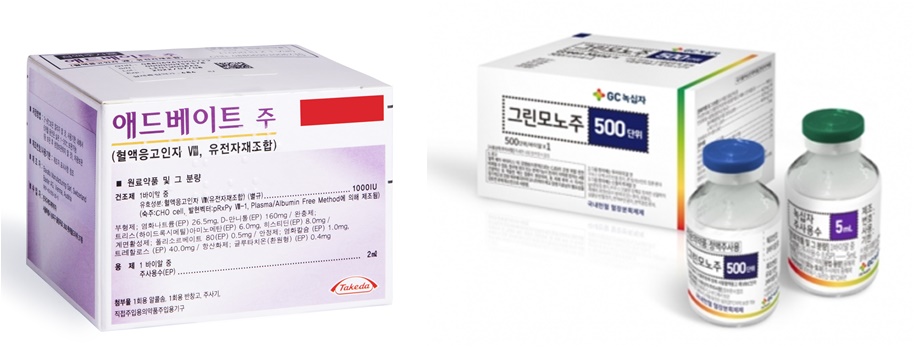
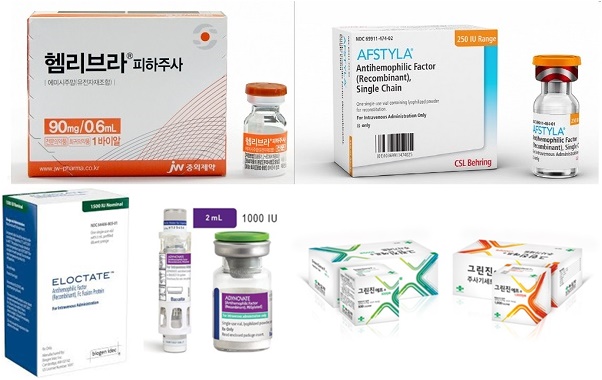
메디칼타임즈=문성호 기자정부가 지난 8월 주요 혈우병 치료제의 급여기준을 확대한 가운데 임상현장 중심으로 '형평성' 논란이 일고 있다.특정 치료제만 급여기준 확대 대상에서 제외됐다는 이유에서다. GC녹십자 혈장유래제제인 그린모노 제품사진. 복지부 급여기준 확대에서 유일하게 제외되면서 임상현장에서 형평성 논란이 제기되고 있다.18일 의료계에 따르면, 지난 8월 보건복지부는 고시 개정을 통해 혈액응고 8인자 결핍 A형 혈우병 치료제에 대한 건강보험 적용범위를 확대 적용한 바 있다. 대한혈액학회 등 임상현장에서 A형 혈우병 응고인자 활성도가 1% 이상 유지할 수 있도록 허가사항 범위 내 최대 용량으로 투여 시 급여를 유지해달라는 요청을 받아들인 것이다.여기서 중증 A형 혈우병은 8인자 수치가 1% 미만인 환자로, 심각할 경우 외상없이도 자연적으로 반복 출혈이 발생해 관절이나 장기에 손상을 일으킬 수 있다. 이 때문에 출혈이 없어도 정기적 응고인자제제를 투여하는 유지요법을 통해 최소 1% 이상 응고인자 수치를 유지하는 것을 권고해왔다. 하지만 치료제의 급여기준 용량 제한으로 인해 국내 혈우병 환자는 출혈 시에도 최대 지혈효과를 기대할 수 없고 유지요법 시에도 투여한 지 2~3일이 지나면 최소 응고인자 수치 1%를 유지하기 어려웠던 상황.이러한 배경으로 복지부는 외래환자 1회 투여용량(1회분)은 20~25 IU/kg으로 설정(다만, 중등도(moderate) 이상 출혈의 경우 의사의 의학적 판단에 따라서 최대 30IU/kg까지 가능)돼 있는데, 용량 증대가 반드시 필요한 3가지 요건에 모두 해당하면 의사소견서를 첨부해 투여용량을 더 늘릴 수 있도록 개정했다.동시에 복지부는 급여기준 확대 과정에서 대상이 되는 '치료제'도 명확히 했다. 8인자 A형 혈우병 제제로 유전자재조합제제인 ▲다케다제약 애드베이트 ▲GC녹십자 그린진에프 ▲화이자 진타솔로퓨즈프리필드 ▲사노피 엘록테이트 ▲다케다제약 애디노베이트 ▲SK케미칼 앱스틸라가 급여기준 확대 대상이다. 문제는 이 같은 급여기준 확대 과정에서 같은 8인자 제제로 분류 가능한 혈장유래제제는 급여기준 확대 대상에서 제외돼 있다는 점이다. 대표 품목을 꼽는다면 GC녹십자의 그린모노다.다시 말해, 복지부는 8인자 A형 혈우병 제제 중 유전자재조합제제만 급여확대 대상으로 삼았다는 뜻이다. 하지만 세계혈우병연맹(WFH) 가이드라인에서는 혈장유래제제와 유전자재조합제제 모두를 표준반감기형 8인자 제제(SHL)로 구분하고 있다. 실제로 WFH 가이드라인(2020)에서는 유전자재조합제제와 혈장유래제제 중 특정제제를 우선 권고하지 않으며 환자의 선호도 및 비용 등을 고려해 선택하도록 하고 있다. 더구나 유전자재조합제제의 국내 도입 시 혈장유래제제가 기준이 돼 급여기준이 설계됐다. 그러나 복지부가 유전자재조합제제 중심 급여기준 확대를 시행하면서 졸지에 혈장유래제제인 그린모노를 투여 받던 환자는 급여기준 대상에서 제외된 상황. 가이드라인 상 같은 8인자 제제를 투여 받고 있었음에도 급여기준 확대 효과를 보지 못하고 있는 셈이다. 이로 인해 임상현장에서는 형평성 면에서 문제가 있다는 지적이 제기되고 있다. 대한혈액학회 임원인 A대학병원 소아청소년과 교수는 "주요 가이드라인 상 유전자재조합제제와 혈장유래제제 모두를 8인자 제제로 구분하고 있는 상황에서 혈장유래제제라는 이유로 제외하는 것은 환자 입장에서는 형평성에 어긋날 수 있다"며 "현장에서도 유전자재조합제제와 혈장유래제제의 처방 시 동일한 지침을 적용하는 대신 약가 등을 고려한 처방을 해왔던 상황에서 문제가 되고 있다"고 평가했다.